in der Literatur ist allenthalben zu lesen, dass es nicht möglich sei, lebensnahe Dauerpräparate von Rädertieren zu erstellen, da die Tiere beim Fixieren kontrahieren. Deshalb findet man im Netz nur Abbildungen von Dauerpräparate mit kontrahierten Tieren (z.B. [url = http://www.rotifera.hausdernatur.at/Rot ... ontage.jpg]Lepadella ovalis[/url]). Auf der anderen Seite wären Dauerpräparate natürlich ein wertvolles Hilfsmittel, um die anatomischen Details der Tiere zu studieren.
Nachdem ich bei Gastrotrichen mit einer MgCl2-Betäubung Erfolg hatte (siehe http://www.mikroskopie-forum.de/index.php?topic=25301.0), dachte ich mir, es könne nicht schaden, diese Methode auch bei Rädertieren auszuprobieren. Da die Ergebnisse recht vielversprechend waren, möchte ich hier einen ersten Zwischenbericht geben:
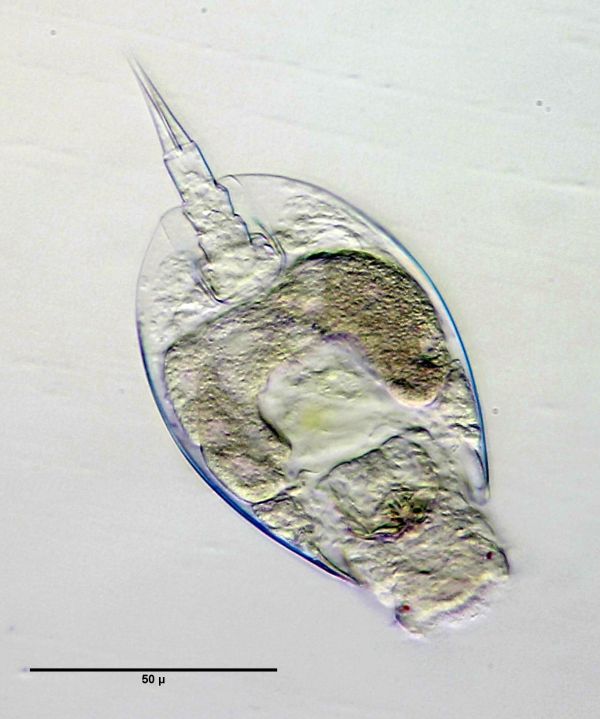
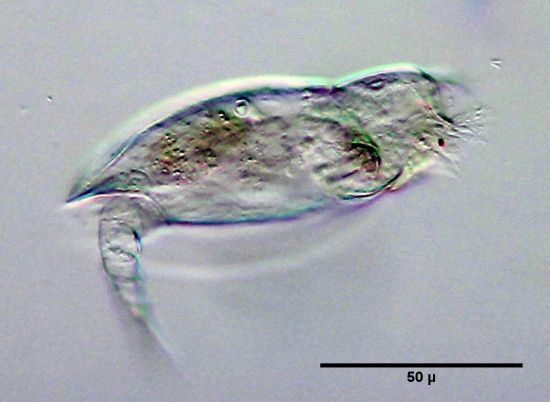
Bild 1: Lepadella sp., in Formaldehyd-Wasser, Aufnahme direkt nach Einschluss, Stack aus 3 Einzelbilder mit Picolay
Fixieren der Tiere
- Die Tiere wurden aus einer Probe in eine Uhrglasschale pipettiert.
- Zu einem Teil Probenwasser wurde ein Teil 2%-MgCl2-Lösung (0,2g MgCl2-Hexahydrat auf 10ml Wasser) zugegeben. In dieser Lösung verblieben die Tiere ca. 5 min. Sie sinken praktisch sofort zu Boden und werden betäubt.
- Der Überstand wurde abgesaugt und reichlich Frischwasser zugegeben. Nach einigen Minuten expandieren die Tiere wieder. Ich habe die Tiere ca. 30min im Frischwasser gelassen. Die Expansion der Tiere sollte am Stemi verfolgt werden, da die Expansionszeit u.A. von der Größe der Tiere abzuhängen scheint. Leider versterben bereits einige Tiere während der Expansion, so dass diese manchmal nicht vollständig abgeschlossen wird (s. Bild 2)
- Überstand absaugen und Fixieren mit 4%-Formaldehyd. Die Tiere liegen jetzt expandiert in Formaldehyd.
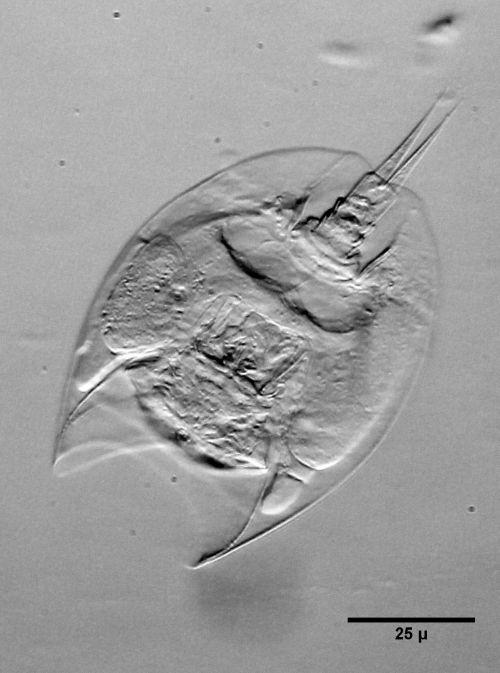
Bild 2: Lepadella sp., in Includal A, nicht expandiert, S/W, ca. 2 Tage nach Einschluss
Einschluss der Tiere
Der Einschluss der Tiere macht mir noch am meisten Schwierigkeiten. Die Tiere sind recht empfindlich gegen osmotischen Druck. Deshalb ist ein Entwässern mit Alkohol praktisch unmöglich. Ein Einschluss in ein Kunstharz-Medium klappt deshalb nicht.
Ich habe folgende Einschluss-Medien erfolgreich getestet:
- Einschluss in Formaldehyd-Wasser: Bei sorgfältiger Durchführung klappt diese Präparation recht gut. Wegen des geringen Brechungsindex ist der Kontrast der nahezu reinen Phasenobjekte ähnlich hoch wie bei der Lebendbeobachtung. Obwohl die Augflecken der Tiere bereits innerhalb weniger Stunden nach dem ihrem Tod verblassen, kann man diese direkt nach dem Einschluss noch gut beobachten, da die Präparate sofort gebrauchsfertig sind. Über die Langzeit-Stabilität der Präparate kann ich nichts genaues sagen. Meine ältesten Präparate sind ca. 10 Monate alt und – bis auf eine fortschreitende Entfärbung – noch in Ordnung. Bei Bedarf kann ich gerne eine genaue Anleitung nachliefern.
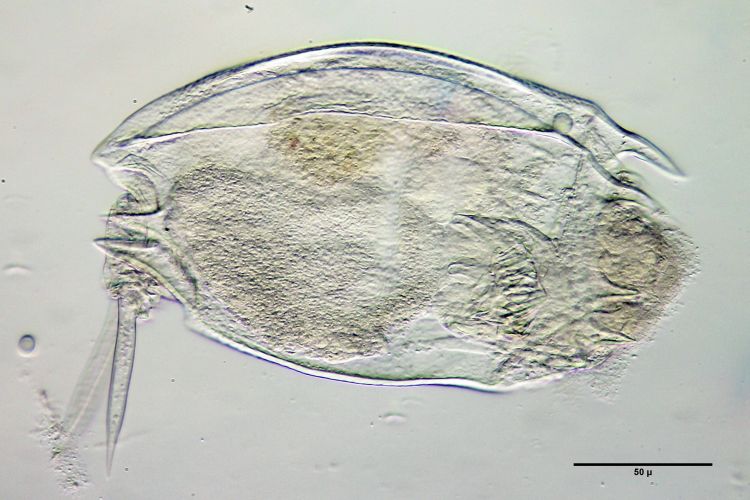
Bild 3: Mytilina mucronata, in Formaldehyd-Wasser, ca. 2 Wochen nach Einschluss - Einschluss in Glycerin: Diese klassische Einschlussmethode klappt gut und erzeugt Präparate, die Jahrzehnte haltbar sind. Der Nachteil ist, dass die Überführung der Tiere nach Glyzerin recht lange dauert, so dass die Tiere erst Wochen nach ihrem Tod beobachtet werden können – Augflecken u. Ä. sind nicht mehr beobachtbar. Auf eine oft empfohlene, vorherige Entwässerung der Tiere sollte verzichtet werden und gleich von Wasser nach Glyzerin überführt werden. Die Verringerung des Brechungsindexes muss in Kauf genommen werden und erhöht bei ungefärben Tieren eher den Kontrast. Alkohollösliche Färbungen bleiben in Glyzerin nicht erhalten.

Bild 4: Mytilina mucronata, in Glycerin, ca. 2 Wochen nach Einschluss - Einschluss in das wasserlösliche Medium nach Apathy (Markenname „Includal A“):
Recht gute Erfahrungen habe ich mit Includal A gemacht. Die Tiere können direkt aus dem Wasser eingeschlossen werden. Um die richtige Schichtdicke zu erzielen, ist aber etwas Erfahrung nötig. Das Deckglas muss wasserdicht (z. B. mit Nagellack umrandet werden).
Die meisten Färbungen bleiben erhalten. Der Brechungsindex ist relativ hoch, so dass der Kontrast bei ungefärbten Tieren etwas sinkt und die Brillanz der Farben intensiviert wird. Eine Beobachtung der Augflecken direkt nach dem Einschluss ist möglich.

Bild 5: Mytilina mucronata, in Includal A, ca. 2 Wochen nach Einschluss
Da wohl die meisten von Euch bereits Rädertiere beobachtet haben, wäre es schön, wenn Ihr beurteilen könntet, ob meine Ergebnisse einigermaßen lebensecht sind. Erkennt man – unabhängig von der fotografischen Qualität - Präparationsartefakte (abgesehen von den fehlenden Augflecken)? Wäre eine Artbestimmung bei so fixiertem Material erfolgversprechend? Kann jemand die Art bei der obigen Lepadella eingrenzen?
Ich hoffe, mein Beitrag war einigermaßen anregende und nicht zu langatmig.
Viele Grüße
Michael