bei Bauchhärlingen erfolgt die Arteinteilung traditionell über die Form der Schuppen. Daher ist die Artbestimmung oft nur möglich, wenn man die Schuppenform der Tiere genau beurteilen kann. Leider sind die Schuppen der Gastrotrichen oft nur schwer zu sehen. Selbst mit DIK - obwohl hier die schwache Doppelbrechung der Schuppen den Kontrast noch zusätzlich verstärkt - ist bei vielen Arten eine Lebendbeobachtung zur Artdiagnose nicht ausreichend. Deshalb möchte ich hier eine Möglichkeit zur Präparation der Schuppen und damit zur (meist) sicheren Artdiagnose vorstellen.
Als Beispiel habe ich Lepidochaetus zelinkai (ehemals Chaetonotus zelinkai) gewählt. Durch das markante Erscheinungsbild dieses Gastrotrichen ist eine Schuppenanalyse zur Artbestimmung eigentlich nicht nötig, aber einige Schuppendetails werden in der Literatur kontrovers diskutiert, so dass ich mir mal selbst ein Bild machen wollte.
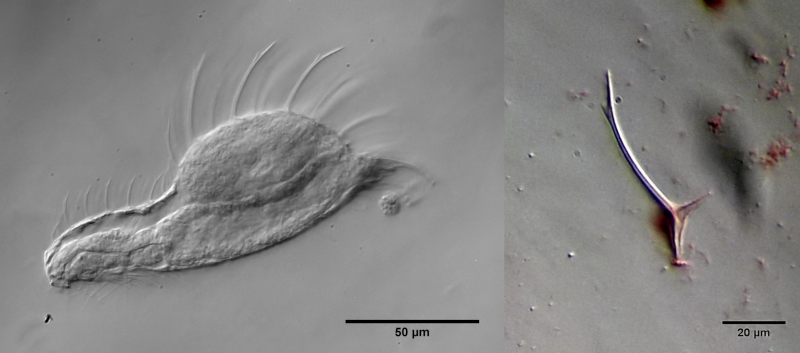
L. zelinkai ist ein mittelgroßer Gastrotrich mit einem markanten Stachelkleid:

Bild 1: Lepidochaetus zelinkai: Übersicht
Selbst bei stärkerer Vergrößerung werden nicht alle Details der Beschuppung deutlich:
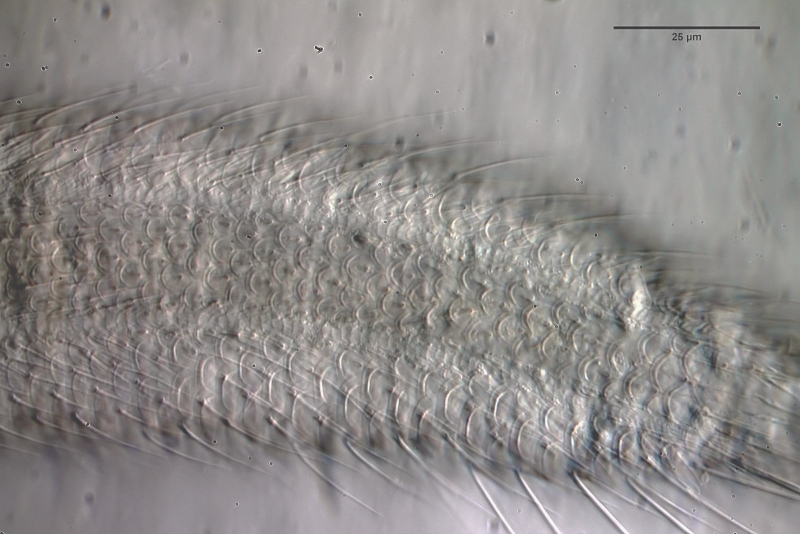
Bild 2: Lepidochaetus zelinkei: Schuppen des ventrales Zwischenfeldes
Um die Schuppen frei zu präparieren, muss das Tier mazeriert werden. Dazu legt man das Tier - am besten mit einem einfachen Vaseline-Kopressorium - mit dem Deckglas fest und zieht einen Tropen Eisessig unter das Deckglas. Den Eisessig haben ich vorab mit sehr wenig Eosin angefärbt - dadurch werden die Schuppen gleichzeitig bei der Mazeration gefärbt. Der Eisessig löst alle Weichteile des Tieres innerhalb weniger Minuten auf, während die Schuppen der Gastrotrichen säurebeständig sind und deshalb erhalten bleiben. Je nach Schuppengefüge verbleiben die Schuppen als zusammen hängende Hülle erhalten oder lösen sich voneinander. Bei L. zelinkai sind die Schuppen anscheinend nicht miteinander verzahnt, so dass die Schuppen sich verteilen:
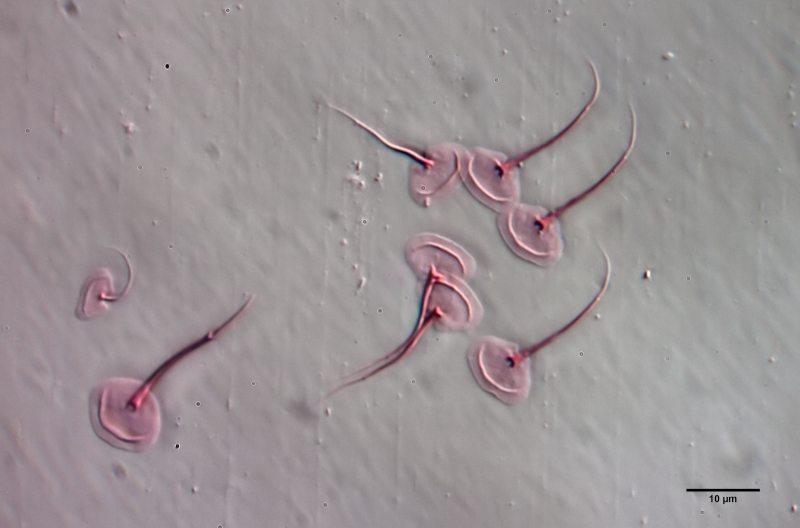
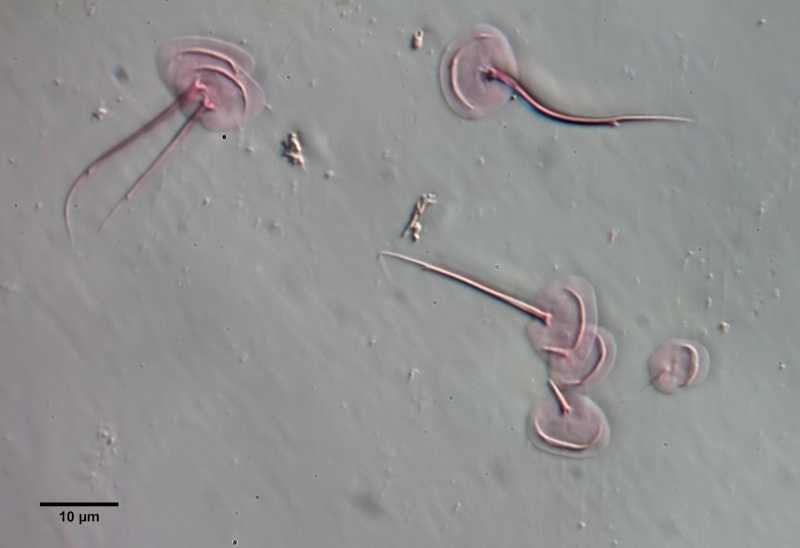
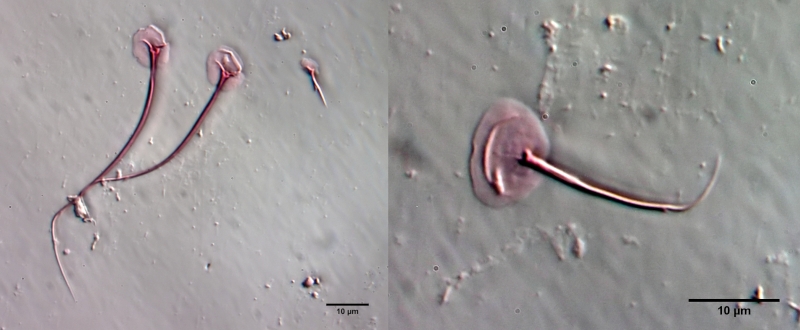
Diese Art der Präparation ist recht einfach und erlaubt es, die Schuppenformen genau zu beurteilen. So fallen z.B. bei den obigen Bildern die Stege in der Schuppenfläche auf, die sich parallel zur Vorderkante erstrecken. In der Literatur werden diese "doppelten Ränder" der Schuppen meist als optisches Artefakt angesehen, das durch den zweifachen Schnitt der Fokusebene durch die gebogenen Schuppen erzeugt wird. Die obige Schuppenanalyse belegt eindeutig, dass diese auffälligen Stege wirklich existieren und eine Verdickung der Schuppen darstellen.
Es wäre natürlich schön, solche Präparate zu einem Dauerpräparat zu verarbeiten. Kennt jemand eine Methode, um ein wässriges Präparat ohne das Deckglas zu entfernen zu einem Dauerpräparat (z. B. in Euparal) zu überführen? Für Tipps wäre ich dankbar!
Viele Grüße
Michael
--------------------
PS: Dieser Beitrag wird parallel im Mikroskopie-Forum veröffentlicht